公司新闻/NEWS
克隆载体构建入门攻略,小白进来学习!
阅读次数:532 发布时间:2022/10/17 11:13:37
载体构建是分子生物学研究常用的手段。通俗地可以描述为将一段目标片段(基因CDS或者用于转录的sgRNA)插入环形DNA里面,并在体内(一般大肠杆菌)高保真复制扩增后用于后续科研实验。根据后续实验目的的不同,通常分为四种类型:
扩增目的基因——构建克隆载体;
表达目的基因——构建表达载体;
编辑基因——构建基因编辑载体;
转染细胞——构建病毒包装载体。
载体的基本构造
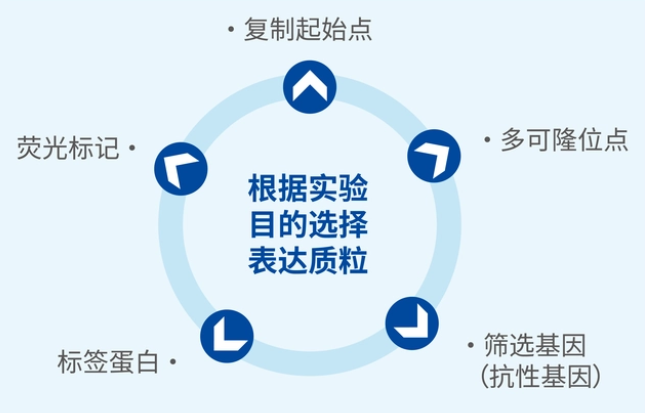
复制起始点:质粒在大肠杆菌中的复制起点,使质粒得以在大肠杆菌中复制,这意味着你插入到质粒中的目标基因可以享受大肠杆菌的高保真复制系统。
抗性基因:带有这个质粒的大肠杆菌可以在有氨苄霉素抗性的LB平板上生长,形成单克隆,而不带有这个质粒的菌株会中毒身亡。可以简单的认为,在抗性平板上长出的菌落代表质粒转化成功。
标签蛋白:以lacZa及其附属元件lac promoter为例,是表达beta半乳糖苷酶的元件,
lacZ可以将无色化合物X-gal切割成半乳糖和深蓝色的物质5-溴-4-靛蓝,菌落成蓝色,lacZ基因中有供目的基因插入的多克隆位点(MSC),如果目基因成功插入,lacZ基因被破坏,无法表达半乳糖苷酶,菌落不能生成蓝色物质,故成白色。可以简单的认为,白色菌落代表目标基因成功插入。
多克隆位点:即酶切位点,是质粒上的限制性酶切位点,可供目的基因插入的位点。
荧光标记:含荧光蛋白的标签如GFP、RFP等,多见于表达载体。
接下来,我们以简单的克隆载体为例,学习下载体构建的具体流程吧!对于构建克隆载体,人们通常采取了多种策略进行克隆,常用的有酶切酶连方法和同源重组方法,这两个方法主要区别有三个方面:,靶基因片段扩增引物有别于常规引物设计;第二,载体切割过程中进行单酶切和双酶切;第三,载体和目的基因片段的连接是基于同源重组或粘性末端互补。
构建克隆载体的流程
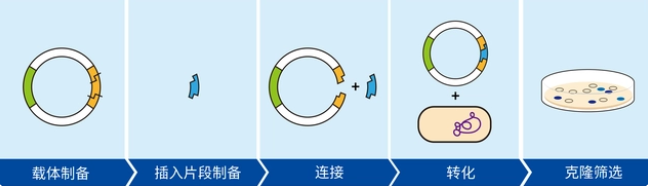
1.载体选择:
根据所要构建的质粒目的的差异以及载体和目标片段的酶切位点分析结果来选择载体。
2.引物设计:
酶切酶连方法的引物设计:设计特异性的目的片段扩增引物,引物的长度一般为18-25bp,GC含量控制在40%-60%,上、下游引物之间GC含量不能相差太大,引物中需要加入两个合适的酶切位点(需要扩增的目的片段上无选择的酶切位点)及保护性碱基。引物设计不当可能在扩增时生成引物二聚体,给实验带来不便。
同源重组方法的引物设计:设计引物时上游引物5’端面加的是酶切位点及该酶切位点在载体中对应面的15个碱基载体片段,下游引物5’端面加的是相同的酶切位点及该酶切位点在载体中对应后面的15个碱基载体片段,如此设计引物是为了保证目的片段插入载体时方向正确,将目标片段扩增出来后以便与载体连接。
3.PCR扩增:
以研究对象的DNA/cDNA为模板,PCR扩增目的基因,在引物两端分别引入合适的酶切位点,使用1%琼脂糖凝胶(根据片段大小选择不同浓度的琼脂糖凝胶)电泳检测和回收回收目的基因DNA条带。
4.载体和目标片段的限制性酶切:
质粒载体和目的基因PCR产物的进行双酶切;使用琼脂糖凝胶(根据片段大小选择不同浓度的琼脂糖凝胶)电泳检测和回收1%琼脂糖凝胶电泳分别回收载体片段部分质粒载体酶切大片段和目的基因酶切片段。
5.连接转化:
使用DNA连接酶进行载体片段部分和目的基因酶切片段质粒酶切回收大片段与目的基因连接的连接,连接反应在16℃反应12 h小时。取10 L连接产物与100 L DH5α感受态细胞细菌混匀后冰浴30 min,42℃热激90 s,立即置冰上放置5 min,加入预热至室温的700 L LB培养基, 37℃恒温摇床培养50 min,吸取 200 L的菌液,用移液器混匀后均匀涂布于含100 g/mL Ampicillin抗性的LB平板上(根据载体上的抗性筛选标记选择合适的抗性平板,以 Ampicillin抗性为例), 37℃恒温培养箱倒置培养过夜。
6.挑取克隆提质粒验证:
(1)菌落PCR验证:挑取5-10个单菌落直接进行PCR验证。
(2)酶切验证:PCR验证阳性的菌落接种于含5 mL,100 μg/mL Ampicillin抗性的LB培养液中,300 rpm,37℃恒温摇床培养过夜。收集菌体,使用,对过夜的菌液进行扩增,选择阳性菌液,用质粒DNA小量提取试剂盒提取质粒进行酶切验证。(也可以不进行酶切验证,直接进测序验证。)
(3)测序验证。
其他类型的载体构建后面会陆续分享,请小伙伴们持续关注。
扩增目的基因——构建克隆载体;
表达目的基因——构建表达载体;
编辑基因——构建基因编辑载体;
转染细胞——构建病毒包装载体。
载体的基本构造

复制起始点:质粒在大肠杆菌中的复制起点,使质粒得以在大肠杆菌中复制,这意味着你插入到质粒中的目标基因可以享受大肠杆菌的高保真复制系统。
抗性基因:带有这个质粒的大肠杆菌可以在有氨苄霉素抗性的LB平板上生长,形成单克隆,而不带有这个质粒的菌株会中毒身亡。可以简单的认为,在抗性平板上长出的菌落代表质粒转化成功。
标签蛋白:以lacZa及其附属元件lac promoter为例,是表达beta半乳糖苷酶的元件,
lacZ可以将无色化合物X-gal切割成半乳糖和深蓝色的物质5-溴-4-靛蓝,菌落成蓝色,lacZ基因中有供目的基因插入的多克隆位点(MSC),如果目基因成功插入,lacZ基因被破坏,无法表达半乳糖苷酶,菌落不能生成蓝色物质,故成白色。可以简单的认为,白色菌落代表目标基因成功插入。
多克隆位点:即酶切位点,是质粒上的限制性酶切位点,可供目的基因插入的位点。
荧光标记:含荧光蛋白的标签如GFP、RFP等,多见于表达载体。
接下来,我们以简单的克隆载体为例,学习下载体构建的具体流程吧!对于构建克隆载体,人们通常采取了多种策略进行克隆,常用的有酶切酶连方法和同源重组方法,这两个方法主要区别有三个方面:,靶基因片段扩增引物有别于常规引物设计;第二,载体切割过程中进行单酶切和双酶切;第三,载体和目的基因片段的连接是基于同源重组或粘性末端互补。
构建克隆载体的流程

1.载体选择:
根据所要构建的质粒目的的差异以及载体和目标片段的酶切位点分析结果来选择载体。
2.引物设计:
酶切酶连方法的引物设计:设计特异性的目的片段扩增引物,引物的长度一般为18-25bp,GC含量控制在40%-60%,上、下游引物之间GC含量不能相差太大,引物中需要加入两个合适的酶切位点(需要扩增的目的片段上无选择的酶切位点)及保护性碱基。引物设计不当可能在扩增时生成引物二聚体,给实验带来不便。
同源重组方法的引物设计:设计引物时上游引物5’端面加的是酶切位点及该酶切位点在载体中对应面的15个碱基载体片段,下游引物5’端面加的是相同的酶切位点及该酶切位点在载体中对应后面的15个碱基载体片段,如此设计引物是为了保证目的片段插入载体时方向正确,将目标片段扩增出来后以便与载体连接。
3.PCR扩增:
以研究对象的DNA/cDNA为模板,PCR扩增目的基因,在引物两端分别引入合适的酶切位点,使用1%琼脂糖凝胶(根据片段大小选择不同浓度的琼脂糖凝胶)电泳检测和回收回收目的基因DNA条带。
4.载体和目标片段的限制性酶切:
质粒载体和目的基因PCR产物的进行双酶切;使用琼脂糖凝胶(根据片段大小选择不同浓度的琼脂糖凝胶)电泳检测和回收1%琼脂糖凝胶电泳分别回收载体片段部分质粒载体酶切大片段和目的基因酶切片段。
5.连接转化:
使用DNA连接酶进行载体片段部分和目的基因酶切片段质粒酶切回收大片段与目的基因连接的连接,连接反应在16℃反应12 h小时。取10 L连接产物与100 L DH5α感受态细胞细菌混匀后冰浴30 min,42℃热激90 s,立即置冰上放置5 min,加入预热至室温的700 L LB培养基, 37℃恒温摇床培养50 min,吸取 200 L的菌液,用移液器混匀后均匀涂布于含100 g/mL Ampicillin抗性的LB平板上(根据载体上的抗性筛选标记选择合适的抗性平板,以 Ampicillin抗性为例), 37℃恒温培养箱倒置培养过夜。
6.挑取克隆提质粒验证:
(1)菌落PCR验证:挑取5-10个单菌落直接进行PCR验证。
(2)酶切验证:PCR验证阳性的菌落接种于含5 mL,100 μg/mL Ampicillin抗性的LB培养液中,300 rpm,37℃恒温摇床培养过夜。收集菌体,使用,对过夜的菌液进行扩增,选择阳性菌液,用质粒DNA小量提取试剂盒提取质粒进行酶切验证。(也可以不进行酶切验证,直接进测序验证。)
(3)测序验证。
其他类型的载体构建后面会陆续分享,请小伙伴们持续关注。
联系我们/CONTACT US
联系人:王宇豪
电 话:021-58993001
手 机:15121072253
地 址:上海市嘉定区曹安公路5588号
邮 编:
传 真:021-50760790
邮 箱:shyuanmusw@163.com
产品分类/CLASS











